У Центрі 31 грудня 2025 року відбулися фінальні перед святами засідання під головуванням директора Михайла Бабенка та заступниці директора з питань реєстрації та аудиту Олени Семенченко. За підсумками розгляду МОЗ України надано 344 експертні рекомендації. Вони стосуються державної реєстрації лікарських засобів і клінічних випробувань. Підсумок демонструє стабільний темп роботи на переході 2025-2026 років.
Що ухвалили на останніх засіданнях
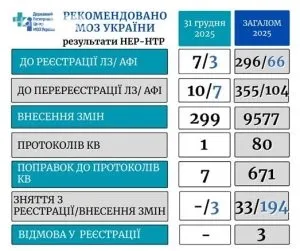
У частині реєстрації ліків запропоновано до реєстрації 7 лікарських засобів і 3 активні фармацевтичні інгредієнти. Рекомендовано перереєструвати 10 лікарських засобів і 7 активних фармацевтичних інгредієнтів. Крім того, підтримано внесення змін до матеріалів для 299 лікарських засобів. Водночас три пакети документів запропоновано зняти з розгляду на етапах експертизи – це робоча процедура для уточнення чи доопрацювання матеріалів.
У сфері клінічних випробувань підтримано до затвердження одне міжнародне багатоцентрове дослідження. Також погоджено 7 поправок до протоколів міжнародних багатоцентрових клінічних випробувань лікарських засобів. Рішення стосуються як імпортованих, так і досліджень, у яких можуть брати участь українські центри. Пакет рішень забезпечує плановість запуску і корекції досліджень у 2026 році.
Ключові підсумки 2025 року та ширший контекст
Протягом року Центр провів 31 засідання науково-експертної ради та 48 засідань науково-технічної ради. За результатами до профільного міністерства направлено більше 11 400 експертних висновків. Серед ключових рекомендацій: зареєструвати в Україні майже 300 позицій лікарських засобів та 66 субстанцій. Також рекомендовано перереєструвати понад 350 лікарських засобів та 100 активних фармацевтичних інгредієнтів.
Окремий блок – зміни до реєстраційних матеріалів, які охопили понад 9,5 тис. лікарських засобів. У клінічних дослідженнях рекомендовано дозволити проведення 80 клінічних досліджень від міжнародних і вітчизняних спонсорів. Додатково підтримано внесення поправок до більш як 670 матеріалів клінічних випробувань. Ці дані відображають високу інтенсивність експертної роботи протягом року.
- 31 засідання науково-експертної ради та 48 – науково-технічної.
- Більше 11 400 експертних висновків до МОЗ України.
- Рекомендації: реєстрації, перереєстрації, зміни в досьє, дозволи на КВ та поправки до протоколів.
За 2025 рік: майже 300 лікарських засобів і 66 субстанцій до реєстрації; понад 350 лікарських засобів і 100 АФІ до перереєстрації; зміни для понад 9,5 тис. лікарських засобів; 80 клінічних досліджень та понад 670 поправок.
Що це означає для пацієнтів і системи охорони здоров’я
Пакет рішень наприкінці року – це база для безперервного доступу до якісних, ефективних і безпечних препаратів у 2026 році. Оновлення матеріалів і контроль за протоколами підвищують прозорість і відповідність міжнародним стандартам. Для пацієнтів це означає плановість поставок і появу нових терапевтичних опцій. Для системи – стабільність регуляторних процесів і прогнозоване планування клінічних досліджень.











