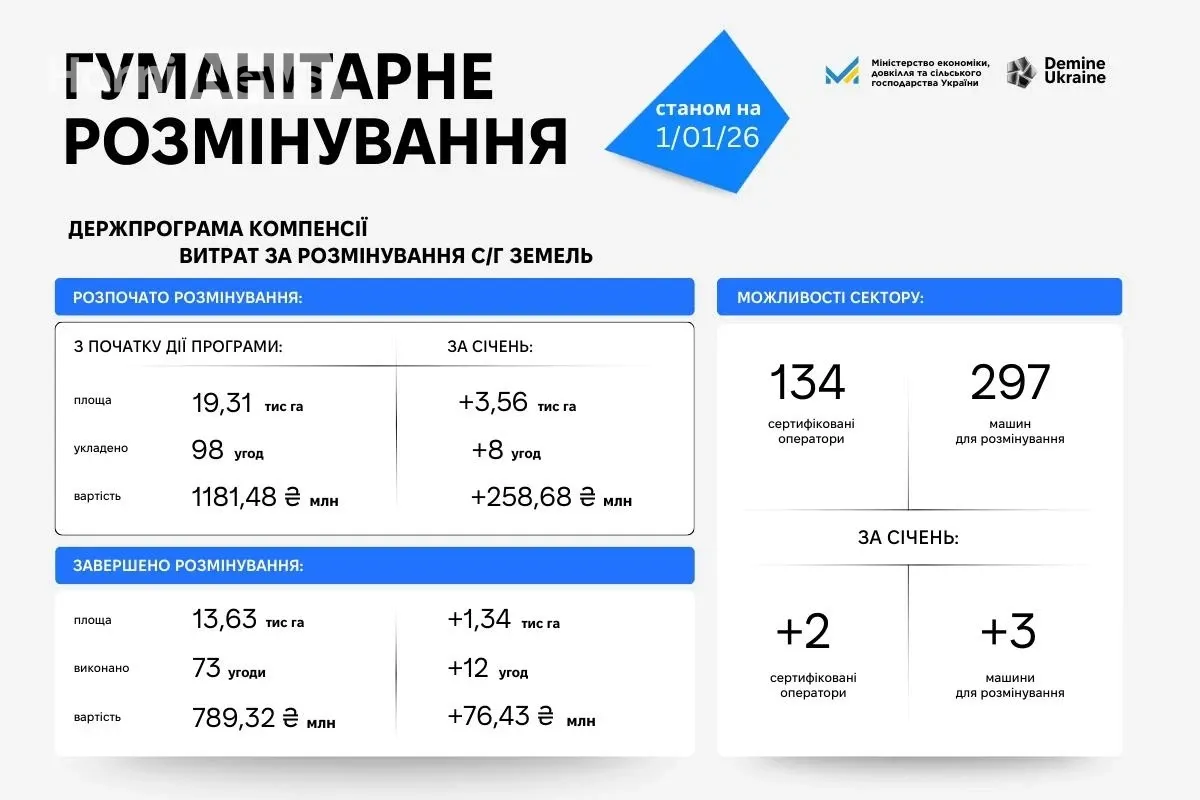
У Центрі 05 лютого відбулося засідання науково-технічної ради, на якому розглянули результати експертиз реєстраційних матеріалів. За підсумками обговорення рекомендовано надати МОЗ України оновлений пакет рішень. Серед них – пропозиції щодо реєстрації субстанцій, перереєстрації готових препаратів та оновлень у досьє. Також затверджено перелік поправок до протоколів міжнародних багатоцентрових досліджень.
Що сталося
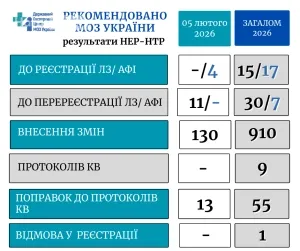
НТР Центру, опрацювавши подані матеріали, рекомендувала МОЗ прийняти рішення щодо кількох напрямів. До державної реєстрації запропоновано 4 субстанції (активні фармацевтичні інгредієнти). До перереєстрації подано 11 лікарських засобів, які вже присутні на ринку. Також погоджено внесення змін у реєстраційні матеріали – 130 лікарських засобів. Окремо схвалено 13 поправок до протоколів міжнародних багатоцентрових клінічних випробувань.
Деталі та контекст
Рекомендації сформовані за результатами експертизи досьє, включно з матеріалами щодо клінічних випробувань та регуляторних змін. Із початку року Державний експертний центр надав профільному міністерству більше 1000 експертних висновків щодо державної реєстрації ліків і досліджень. Це свідчить про стабільний темп опрацювання заяв та підтримку безперервності постачання. Детальна розбивка показників – в офіційній інфографіці Центру.
Ключові акценти засідання:
- Реєстрація нових АФІ – 4 позиції для виробництва ліків в Україні.
- Поновлення дії реєстраційних посвідчень – 11 препаратів після перереєстрації.
- Оновлення досьє – 130 лікарських засобів отримали погоджені зміни.
- Міжнародні дослідження – 13 поправок до протоколів для узгодженості та безпеки.
За інформацією Центру, з початку року надано більше 1000 експертних висновків щодо державної реєстрації ліків в Україні та проведення клінічних випробувань.
Що це означає
Для пацієнтів це може означати ширший вибір терапій та стабільнішу доступність препаратів після завершення процедур у МОЗ. Для виробників схвалені зміни та реєстрації АФІ відкривають можливість швидше оновлювати досьє і планувати виробництво. Для дослідницьких центрів затверджені поправки підтримують безперервність міжнародних випробувань та відповідність протоколам. Надалі рішення МОЗ за цими рекомендаціями визначать терміни виходу оновлень і продуктів на ринок.